अम्ल, क्षारक एवं लवण
NCERT डिजिटल क्लासरूम • विज्ञान (कक्षा 10)
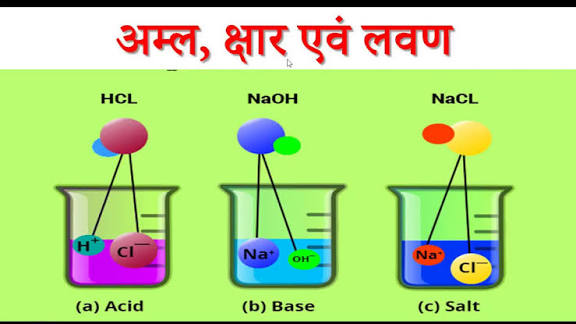
अम्ल (Acids)
स्वाद में खट्टे, नीले लिटमस को लाल करने वाले और जलीय विलयन में H+ आयन देने वाले पदार्थ। इनका pH मान 7 से कम होता है।
क्षारक (Bases)
स्वाद में कड़वे, लाल लिटमस को नीला करने वाले और जलीय विलयन में OH– आयन देने वाले पदार्थ। ये साबुन जैसे चिकने होते हैं।
लवण (Salts)
अम्ल एवं क्षारक की परस्पर अभिक्रिया से बनने वाले उदासीन ठोस यौगिक लवण कहलाते हैं। जैसे साधारण नमक (NaCl)।
उदासीनीकरण (Neutralization)
परिभाषा: जब किसी अम्ल और किसी क्षारक को आपस में मिलाया जाता है, तो वे एक-दूसरे के प्रभाव को समाप्त कर देते हैं। इस रासायनिक अभिक्रिया के परिणामस्वरूप लवण (Salt) और जल (Water) का निर्माण होता है। इस प्रक्रिया को ही ‘उदासीनीकरण’ कहते हैं।
अम्ल + क्षारक ⟶ लवण + जल + ऊष्मा
मुख्य उदाहरण (Example):
जब हाइड्रोक्लोरिक अम्ल और सोडियम हाइड्रोक्साइड की क्रिया होती है:
HCl + NaOH ⟶ NaCl + H₂O
महत्वपूर्ण रासायनिक सूत्र
1. प्रमुख अम्ल (Acids)
| नाम | सूत्र | विवरण |
|---|---|---|
| सल्फ्यूरिक अम्ल | H₂SO₄ | गंधक का अम्ल |
| नाइट्रिक अम्ल | HNO₃ | शोरे का अम्ल |
| एसिटिक अम्ल | CH₃COOH | सिरका |
| फॉर्मिक अम्ल | HCOOH | चींटी का डंक |
2. प्रमुख क्षारक (Bases)
| नाम | सूत्र | विवरण |
|---|---|---|
| सोडियम हाइड्रोक्साइड | NaOH | कास्टिक सोडा |
| कैल्शियम हाइड्रोक्साइड | Ca(OH)₂ | बुझा हुआ चूना |
| मैग्नीशियम हाइड्रोक्साइड | Mg(OH)₂ | मैग्नीशिया दूध |
3. प्रमुख लवण (Salts)
| नाम | सूत्र | विवरण |
|---|---|---|
| सोडियम क्लोराइड | NaCl | साधारण नमक |
| सोडियम कार्बोनेट | Na₂CO₃.10H₂O | धोने का सोडा |
| कैल्शियम सल्फेट अर्धहाइड्रेट | CaSO₄.½H₂O | प्लास्टर ऑफ पेरिस |
| पोटैशियम एल्युमिनियम सल्फेट | K₂SO₄.Al₂(SO₄)₃.24H₂O | फिटकरी |